作者:許柏洋/有勁基因
新冠肺炎疫情延燒,全球確診人數持續攀升;部分國家在短暫解禁後又出現確診高峰的情形。良好的篩檢機制能及早檢出病毒帶原者、加以隔離並防止疫情擴散;特別是在疫苗及治療藥物尚未完備的情況下,建立迅速且準確的篩檢方式,相形之下更是重要。現今新冠病毒的篩檢方式主要有三類:核酸檢測、抗體檢測、及抗原檢測;其中核酸檢測因為準確度較高及偽陰性情況較低等優點而廣為各國採用。
目前新冠肺炎病毒的主流核酸檢測方式是利用聚合酶連鎖反應(Polymerase Chain Reaction; PCR)技術將檢體中的核酸放大以檢測其中是否帶有入侵的新冠病毒RNA。不過,傳統PCR技術操作過程繁複且過程中需要反覆升降溫度以裂解及黏合DNA產物,所以儀器方面需要仰賴精準的溫度循環系統;假如循環控溫儀器缺乏或操作人員不足,就很難採行此法。此外,傳統PCR核酸檢測時程約需4小時,一旦面對大量檢體,短時間內也很難取得結果。
日本學者Notomi 等人在2000年發表了恆溫環狀擴增法(Loop-Mediated Isothermal Amplification; LAMP)這個核酸增幅技術1,為核酸檢測提供了新的技術選擇。有別於傳統PCR技術,LAMP核酸增幅技術的操作簡單、作用時間短,且整個反應過程可在60-65℃的恆溫環境下完成,不需要溫度控制系統,因此很適合用在現場或床邊檢測上。LAMP核酸增幅過程中的DNA裂解需仰賴像Bst polymerase這些具有高度DNA鏈置換活性的聚合酶去鏟開模版DNA的雙股構造。這個技術還需要內、外2組引子對(Inner Primers & Outer Primers)去標定6個特定區域的目標核酸序列⼀F1, F2c,F3c,B1,B2c,及B3c (c代表該區域的互補序列。如F1c 為F1區域的互補序列)。內、外引子對在增幅過程中是負責啟動DNA合成、並引發後續自發的一連串增幅動作。LAMP反應若再加入1組環形引子(Loop Primers)更可提升整體反應的效率。這些引子對的序列分別如下:
● 1組內引子對:分別是FIP (Forward Inner Primer)及BIP (Backward Inner Primer;前者包含F1c及F2兩個序列,後者包含B1c及B2兩個序列。
● 1組外引子對:分別是F3 (Forward Outer Primer)及B3(Backward Outer Primer)
● 1組環形引子對:分別是Loop F (LF;Forward Loop Primer)及Loop B(LB;Backward Loop Primer)
下圖一DNA上這些引子序列的位置,從5′端到3′端分別是B3-B2-LB-B1 和F3-F2-LF-F1(如圖一Target DNA步驟所示) 2,3。在LAMP進行時,內引子對會與F2c及B2c鍵結並合成新的DNA鏈,之後外引子對會與F3c及B3c鍵結並合成新鏈;由於外引子對位在內引子對的5′′端,而LAMP反應所選用的DNA聚合酶具有高度的DNA鏈置換功能,所以當外引子對開始啟動DNA聚合時,就會將下游(3′′端)內引子對所合成的DNA鏈鏟開變成單股。在單股狀態下,由內引子對所合成的DNA鏈兩端上的F1c & B1c序列就會跟下游F1、B1序列形成啞鈴型環狀結構的DNA中間產物(如圖一Initiation step步驟所示) 2,3。接著,這些環狀模版DNA會持續與其他內引子序列結合(self-priming),不斷地形成雙重圈環結構,藉此接連重複的反應來放大目標產物(如圖一Cycling amplification step步驟所示)、甚至不斷增幅成為長鏈狀的終端產物(如圖一Elongation step步驟所示)2,3。LAMP核酸增幅技術的檢測靈敏度很高,可達到傳統RT-PCR的1000倍左右4。
圖一、LAMP核酸增幅技術的原理及分子運作機制
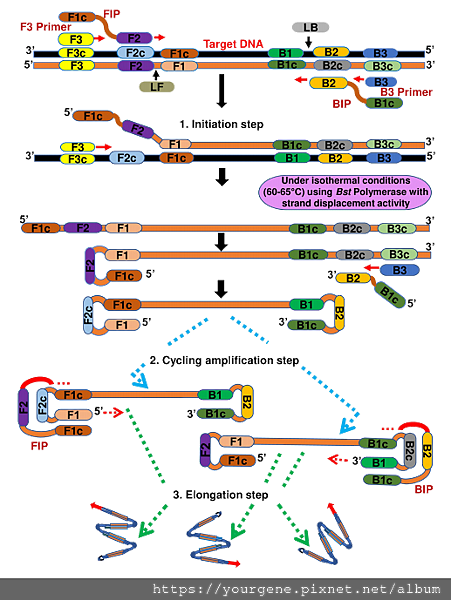
圖片來源:Nzelu, C.O., Kato, H. &Peters, N.C. PLoS Negl Trop Dis. 2019 Nov; 13(11): e0007698- e0007719
LAMP核酸增幅技術除了具有耗時較短、操作較簡單且不需PCR儀器等優點外,在反應過程中還可藉由肉眼觀察中間產物⼀焦磷酸鎂(magnesium pyrophosphate)的白色沈澱產生情形來判斷目標DNA的放大狀況,還可以利用混濁度計量儀或螢光染色來迅速取得檢測結果。LAMP應用於新冠病毒檢測的例子5,如下圖二所示。
圖二、 新冠肺炎病患樣品的LAMP檢測結果
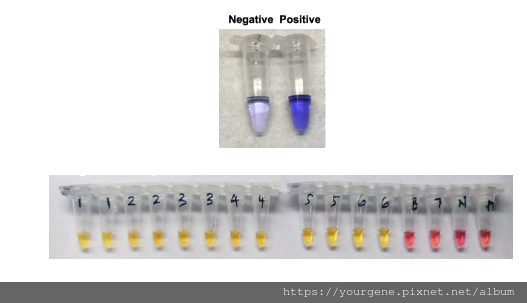
圖片來源:(上圖) El-Tholoth, M., Bau, H.H. &Song, J. ChemRxiv. Preprint. 2020 Feb. (下圖) Zhang Y, medRxiv. Preprint. 2020 Feb.
上圖為以結晶紫染劑探測LAMP產物中雙股DNA的模擬測試,用來作為LAMP於新冠病毒檢測的陽性和陰性對照組。下圖為新冠肺炎病人實際樣品的LAMP檢測結果;黃色表示陽性檢出,粉紅色為未檢出。樣品編號1至6號的RT-PCR篩檢結果為陽性,7號為陰性。B號,N號,及P號為空白組(不含DNA)、陰性控制組、及陽性控制組。
雖然LAMP核酸增幅技術優點多多,有些國家如日本也已將之用在臨床的新冠肺炎核酸檢測上;但LAMP的應用仍然有一些侷限,例如:過程中一旦操作不當便容易造成「偽陽性」的結果、引子對的設計困難、目標核酸的特定區域選擇不易等等。同時,LAMP技術雖然好用,目前它還是無法完全取代傳統PCR的檢驗功能。
參考文獻
1. Notomi, T., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 2000 Jun;28(12):E63. Retrieved from https://doi.org/10.1093/nar/28.12.e63
2. Nzelu, C.O., Kato, H. &Peters, N.C. Loop-mediated isothermal amplification (LAMP): An advanced molecular point-of-care technique for the detection of Leishmania infection. PLoS Negl Trop Dis. 2019 Nov;13(11): e0007698- e0007719. Retrieved from https://doi.org/10.1371/journal.pntd.0007698
3. 衛生福利部疾病管制署 (2004)。新型恆溫式圈環形核酸增幅法簡介與應用。疫情報導,20(6),323-332。檢自:https://www.cdc.gov.tw/File/Get/kOlpcBlLkvOvWHLluofgaA
4. Pro Tech (2017)。LAMP技術專刊。檢自:波士特生物科技股份有限公司http://www.bio-protech.com.tw/upload/20171108061030.pdf
5. Kashir, J. &Yaqinuddin, A. Loop mediated isothermal amplification (LAMP) assays as a rapid diagnostic for COVID-19. Med. Hypotheses. 2020 Aug;141:109786-109790. Retrieved from https://doi.org/10.1016/j.mehy.2020.109786
6. El-Tholoth, M., Bau, H.H. &Song, J. A Single and Two-Stage, Closed-Tube, Molecular Test for the 2019 Novel Coronavirus (COVID-19) at Home, Clinic, and Points of Entry. ChemRxiv. Preprint. 2020 Feb. Retrieved from https://doi.org/10.26434/chemrxiv.11860137
7. Zhang, Y. et al. Rapid Molecular Detection of SARS-CoV-2 (COVID-19) Virus RNA Using Colorimetric LAMP. medRxiv. Preprint. 2020 Feb. Retrieved from https://doi.org/10.1101/2020.02.26.20028373





 留言列表
留言列表 {{ article.title }}
{{ article.title }}
