作者:劉祥欽/有勁基因
【DNA電泳染劑的種類及其原理】
DNA電泳是分子生物學實驗的基礎之一,其原理是利用電流將放進電泳槽中的混合DNA片段依分子量大小一一分開。我們一般會將電流導入電極兩端的TAE或TBE緩衝液中,DNA分子因為磷酸根帶負電之故,因此會在瓊脂糖凝膠(Agarose gel)的多孔隙膠體內順著電流朝向正電極的方向泳去,DNA片段的分子量越大,在膠體孔隙中泳動的速率就越慢,於是便可將混合的DNA片段按照分子量大小不同,一一分開。
DNA片段分開後,要想知道每個片段的大小,得先用螢光染劑染色,才能「看」到DNA的位置。DNA螢光染劑依其染色時與DNA結合方式的不同,大致可分為三類:第一類會崁入DNA雙螺旋鹼基對之間的縫隙(又稱DNA嵌入劑;DNA intercalator),例如Ethidium Bromide(EtBr);第二類會與DNA雙股螺旋結構外側溝槽上的磷酸根進行正負電結合,例如SYBR系列的螢光染劑;第三類同樣也是崁入DNA雙螺旋鹼基對之間的縫隙,不同的是,另有鏈結會將前後兩個類EtBr結構串連起來(又稱為Bis-intercalator),例如GelRed。
【DNA染劑的染法及優缺點】
DNA染劑的染法有三種:內染(precasting)、外染(post-staining)及前染(prestain)。
內染是在膠體製作的當下將染劑一同加入,跑膠時DNA便會沿路收集遇到的染劑。內染的解析度較外染高,且不須退染,所以也比外染省時間。然而如果所使用的染劑是帶正電的螢光染劑,例如SYBR系列,則在跑膠過程中會因為電場的關係而反向往上移動,膠體會呈現上亮下暗的不均勻現象。
外染是在電泳結束後才將膠體浸入稀釋的染劑中浸泡,因此染劑對DNA在膠體上的分布位置不會造成任何影響,看到的電泳結果會是最正確的。然而外染需要另外再花時間退染,且染劑耗量很大(約為內染的十倍),所以並不是一項經濟的做法。
前染是在電泳前配製DNA與電泳指示劑(loading dye)混合液時,便將DNA螢光染劑一起混入。前染的好處之一是經濟實惠,不必為了只跑一個樣品而浪費一整片膠的DNA螢光染劑;而且因為所有染劑都在DNA混合液裏,所以照相時DNA與背景的對比是最好的。此外可以使用預製的電泳膠,不需要每次在跑膠前做含染劑的膠,或得在跑完膠後染膠,可說是最方便的染法。
【前染會面臨的風險】
三種染法中,前染可說集眾優點於一身;然而,它有一個很大的缺點,那就是會造成DNA的片段飄移(band migration)現象。不同的DNA染劑其實都有可能造成DNA片段飄移,但成因各不相同。舉例來說,GelRed螢光染劑所造成的DNA片段飄移,應該是過量DNA搶奪不足的染劑的結果。我們先假設染劑充足時跑出來的位置為正確的,一旦DNA過量,每一條DNA可分配到的染劑便減少了。由於GelRed染劑本身就相當有份量(1,239.07 g/mol),因此即使每條DNA都一樣長,附載到較少染劑的DNA因為比較輕,跑起來就是比附載較多染劑的DNA來得快。所以當GelRed染劑的用量固定時,DNA的濃度絕對不能過高,一旦濃度超過標準,隨著濃度的增加,每條DNA上所附載的GelRed染劑就會越來越少,然後就越跑越快(如圖1所示)。事實上, GelRed在一倍濃度使用量下,以10 uL總DNA樣品量來說,官方建議跑電泳時,每個樣品一次不要放入超過20 ng的DNA【註1】;由此可見,前染時若採用GelRed當染劑,DNA量的控制將是決勝的關鍵。
SYBR系列的染劑用在前染時,同樣也有造成DNA片段飄移的風險。成因除了上述染劑不足造成的DNA質量差異之外,帶正電的SYBR染劑與帶負電的DNA會正負電結合,因為DNA上的負電被抵銷了,以致DNA跑膠的動能降低1。所以當染劑不足時,電泳置入的DNA量若較多,則每條相同長度的DNA片段所能分配到的正電染劑量就會比較少,於是在質量較輕、負電被抵銷得又較少的情況下,跑膠的速度自然是比DNA置入量較少的樣品快。但這部分因為還沒有官方資料,因此只能從相關報導中的實驗數據推敲出可能的解釋。
2010年Qing Huang團隊有篇實驗報導2就曾指出:前染時,若採以100倍濃度的GelRed染劑便能有效防止DNA片段飄移狀況的發生(詳見圖2A);但就SYBR Gold跟SYBR Green這兩種染劑而言,即使用量增加到100倍,DNA片段飄移仍然會發生,甚至更嚴重(詳見圖2B、圖2B)。由此我們推測,對GelRed染劑來說,當用量充足時,所有DNA樣品都有機會分配到相同量的染劑,因此就比較不會出現DNA片段飄移的狀況。而對SYBR Gold及SYBR Green染劑來說,由於染劑與DNA有正負電結合的特性,結果不但會增加DNA的質量,還會消耗掉DNA所帶的負電,DNA跑電泳的速度因而被拖得更慢;所以這類染劑一旦用量不足,DNA置入量與電泳跑速成反比的情況就會比GelRed染劑來的更嚴重。
【如何克服DNA片段飄移的問題?】
如前面所述,增加GelRed染劑的使用量可以克服DNA片段飄移的問題,但增加百倍用量也就代表要增加百倍花費;之後若想要再提升DNA的置入量時,就算是用了百倍的染劑量,可能也無力阻止DNA片段飄移現象再度發生,染劑的用量於是又得再跟著提昇,因此這並不是一個治本的做法。
為了克服DNA片段飄移這個問題,Biotium這家公司在2018年推出了新的染劑產品—GelRed® Prestain Plus 6X DNA Loading Dye (41011, Biotium)。從官方提供的示範結果來看,似乎是可以有效地克服DNA片段飄移這個問題。跟原始版本的GelRed染劑(6X GelRed® Prestain Loading Dye)相比,跑電泳後的螢光位置不再因為DNA置入量的增加而向下飄移,而且電泳結果所呈現的亮帶,其亮度比例也和DNA的實際置入量更相符(詳見圖3)。Biotium公司究竟做了什麼,竟能讓前染時GelRed染劑的DNA片段飄移問題獲得改善,我們不得而知;但他們的新產品的確能在這裡取得更全面有效的成果。
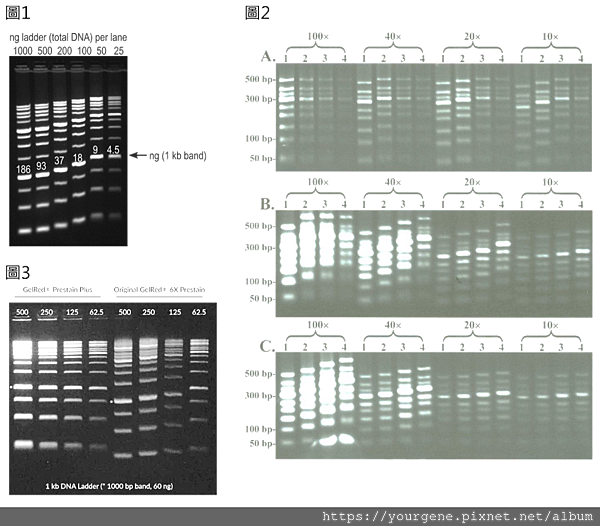
圖1、GelRed螢光染劑用於前染時出現的DNA片段飄移現象
以6倍GelRed螢光染劑作為電泳指示劑對25 ng至1000 ng的1 Kb DNA梯狀電泳條帶(DNA ladder)進行前染,然後在含1% TBE緩衝液的瓊脂糖凝膠中跑膠的結果。箭頭所指的螢光亮帶(band)是1 Kb DNA的位置,而亮帶上方標示的數字即為該亮帶的質量。(圖片來源: Biotium. (2013, Apr. 30). Product Information: 6X GelRed™ Prestain Loading Buffers.)
圖2、比較GelRed及SYBR系列螢光染劑用於前染時的DNA片段飄移問題
以GelRed(2A), SYBR Gold(2B)及SYBR Green(2C)三種螢光染劑分別對6.25 ng到50ng的50 bp DNA梯狀電泳條帶進行前染(標示數字1~4,分別代表#1: 50 ng;#2: 25 ng;#3: 12.5 ng;#4: 6.25 ng),然後在2.5%瓊脂糖凝膠中跑膠的結果。圖中100x, 40x, 20x, 10x分別是指用10,000倍濃度的染劑去稀釋的倍數。(圖片來源: Huang, Q., Baum, L. & Fu, W.L. Clin Lab. 2010;56(3-4):149-52.)
圖3、GelRed® Prestain Plus 6X DNA Loading Dye
GelRed® Prestain Plus 6X DNA Loading Dye與原始版本的6X GelRed® Prestain Loading Dye進行比較。以這兩種染劑對62.5 ng到500 ng的1 Kb DNA梯狀電泳條帶做前染,然後在含1% TBE緩衝液的瓊脂糖凝膠中跑膠的結果。*星號所標示的螢光亮帶是質量60 ng的1 Kb DNA的位置;顯示新產品染劑可以改善DNA片段飄移的情形,而且電泳結果所呈現的亮帶亮度比例也和DNA的實際置入量更相符。(圖片來源: Biotium. (2018, Nov. 12). Product Information: GelRed® Prestain Plus 6X DNA Loading Dye.)
【註1】For best results, the 10 uL sample should contain between 50-100 ng DNA for ladder, or 10-20 ng DNA per band. Retrieved from https://biotium.com/product/6x-gelred-prestain-loading-buffer-with-tracking-dye/
參考文獻
1. Dragan, A., et al. SYBR Green I: fluorescence properties and interaction with DNA. Journal of fluorescence. 2012, Apr;22:1189-1199. Retrieved from https://link.springer.com/article/10.1007/s10895-012-1059-8
2. Huang, Q., Baum, L. & Fu, W.-L. Simple and practical staining of DNA with GelRed in agarose gel electrophoresis. Clin Lab. 2010;56(3-4):149-52. Retrieved from https://www.ncbi.nlm.nih.gov/pubmed/20476647
3. Biotium. (2013, Apr. 30). Product Information: 6X GelRed™ Prestain Loading Buffers. Retrieved from https://biotium.com/wp-content/uploads/2013/07/PI-41009-41010.pdf
4. Biotium. (2018, Nov. 12). Product Information: GelRed® Prestain Plus 6X DNA Loading Dye. Retrieved from https://biotium.com/wp-content/uploads/2018/11/PI-41011.pdf





 留言列表
留言列表 {{ article.title }}
{{ article.title }}
