作者:葉佳妤/有勁基因
人類粒線體DNA(mitochondrial DNA; mtDNA)是具有16,569個鹼基的雙股環狀DNA分子,mtDNA基因體中有97%屬於編碼序列 (coding sequence),共囊括了37個基因,其中13個可轉錄轉譯成和氧化、磷酸化有關的蛋白質,負責細胞的有氧呼吸作用,22個可轉錄成轉運RNA (transfer RNA; tRNA) ,2個可轉錄成核糖體RNA (ribosomal RNA; rRNA),一起負責粒線體中的轉譯工作。
粒線體是細胞的發電廠。mtDNA會和細胞核DNA (nuclear DNA; nDNA) 共同合作,使整個粒線體具備完整功能,因此mtDNA基因體能否維持正常,對粒線體來說相當重要。mtDNA一旦發生突變,就有可能引起一連串無法治癒的代謝性疾病(詳見圖一) 1。因此,mtDNA基因編輯工具的開發,長期以來一直是粒線體遺傳學的研究目標。
圖一、粒線體疾病的臨床徵狀
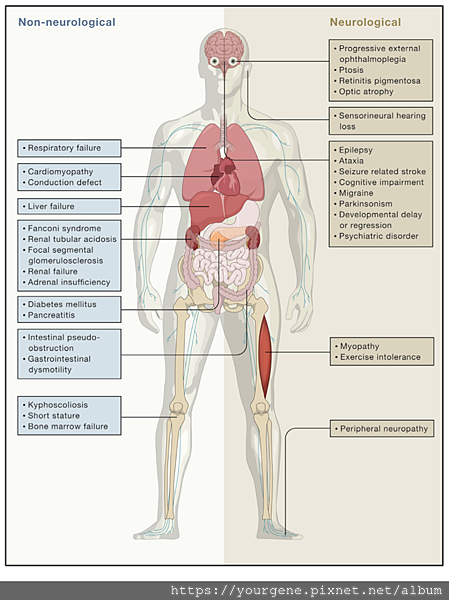
粒線體功能障礙可引起神經和非神經系統內的一連串疾病或徵狀。由於這些疾病所涉及的組織和器官變化會受到不同突變(mtDNA或nDNA)、不同發病年齡、粒線體異質性(heteroplasmy)等因素影響,因此疾病的進程難以預測。(圖片來源:Russell, O.M., Gorman, G.S., Lightowlers, R.N., Turnbull, D.M. Cell. 2020 Apr;181(1):168-188.)
美國Mok研究團隊今年在Nature期刊發表了一篇研究,指出細菌會分泌一種稱作DddA2, 3的胞嘧啶核苷脫氨酶(cytidine deaminase),這種酵素對哺乳動物的細胞具有毒性。以前所發現的其他胞嘧啶核苷脫氨酶都只會針對單股DNA進行作用,如果要用來做基因編輯工具的話,過程中都需先用核酸酶將雙股DNA切開,讓雙股DNA斷裂之後,才能繼續作用。然而,DddA卻可以直接在雙股DNA上進行作用,基因體的雙股DNA不需先被打斷;因此DddA對於沒有雙股DNA斷裂修復系統(DNA double-strand break repair system)的粒線體來說,是相當適合的基因編輯候選工具。
為了讓DddA能夠作為mtDNA的基因編輯工具,團隊克服了許多問題。首先,他們利用基因工程技術將DddA具毒性的功能結構區(domain)拆分成兩個無活性的單元,稱為split DddAtox,然後將這兩個無活性單元分別與TALE蛋白質(Transcription Activator–Like Effectors)進行融合。使用TALE的理由是因為:TALE蛋白質具有結合特定粒線體DNA序列的能力,當其為了辨識該特定序列而將兩單位的split DddAtox結合在一起時,DddA的功能就會活化,然後去催化細胞基因體中胞嘧啶(cytosine; C)的脫氨作用,使胞嘧啶轉變成尿嘧啶(uracil; U)。研究團隊為了把split DddAtox順利送入粒線體中,在TALE蛋白質上有另外接上一段能指向目的地的胺基酸序列(粒線體指向序列Mitichondrial targeting sequence)作為標誌訊號,以便此構造一進入細胞就能被送到粒線體內去發揮作用。(詳見圖二)
解決以上困難之後,還有另一個問題,因為DddA的能力是將胞嘧啶C轉換成尿嘧啶U,而不是轉成DNA能使用的胸腺嘧啶(thymidine; T),因此,自然狀況下,轉成的U之後就會在尿嘧啶醣基化酶(uracil-DNA glycosylase)的幫助下,從DNA上被移除,改由C取代。為了讓被DddA酵素轉化成的U能夠被保留到下次細胞複製之時,Mok團隊於是又融合了一個尿嘧啶醣基化酶抑制蛋白(uracil glycosylase inhibitor; UGI)到TALE-split DddAtox融合蛋白上;有了UGI的加入,編輯胞嘧啶鹼基的效率可提高八倍左右。這個基因工程最終的產物被命名為DdCBE (doubled DddA-derived cytosine base editor),可用來作為有效的mtDNA基因編輯工具(詳見圖二),以修正粒線體基因體的突變,進而減緩粒線體疾病的嚴重程度。
圖二、粒線體基因體編輯工具:DdCBE
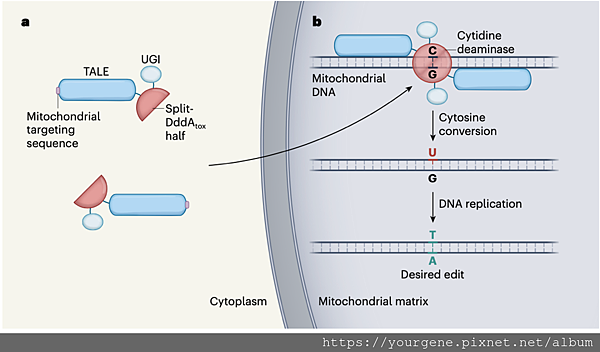
Mok團隊開發出的基因編輯工具DdCBE(圖a),可以將粒線體中的C-G核苷酸配對改編成A-T核苷酸配對(圖b)。如左圖所示,DdCBE可以被分開成兩個相同的單元,每個單元皆包含:(1)被稱為split DddAtox的細菌毒素無活性單元、(2)能結合特定mtDNA序列的蛋白質TALE和(3)能將split DddAtox導入粒線體基質的胺基酸序列(Mitichondrial targeting sequence),以及(4)尿嘧啶醣基化酶抑制蛋白UGI。右圖中,DdCBE的兩個單元都被送入粒線體基質後,TALE會辨別特定的mtDNA序列並與之結合,於是讓兩個無活性的split DddAtox有機會結合回DddA而被活化,然後就可以催化mtDNA中胞嘧啶(C)的脫氨作用,使其轉變成尿嘧啶(U),而且,有了UGI的保護,此U可以一直保留至下次DNA複製時;經過具有半保留特性的DNA複製之後,被DdCBE轉化鹼基過的C-G配對,一半仍會維持C-G配對,但另一半將可轉變為T-A配對,達到基因編輯的目的。 (圖片來源: Aushev, M., Herbert, M. Nature. 2020 Jul;583(7817):521-522.)
所有基因編輯工具都會面臨是否會發生脫靶效應(off-target effect)的挑戰,Mok團隊因此特別去比較經DdCBE處理過與未處理的細胞。結果並未發現DdCBE在核基因體中有發生任何脫靶效應;在mtDNA中的脫靶效應機率也相當低。此外,團隊研究認為DdCBE具有治療潛力,可以修正將近半數(49%)目前已知有害的mtDNA突變。雖然DdCBE只能有效編輯基因體中胞嘧啶的突變錯誤,應用範圍似乎有侷限,但即便如此,Mok團隊所開發的DdCBE編輯工具對mtDNA的基因編輯研究來說,仍是一個重要的里程碑。
參考資料
1. Russell, O.M., Gorman, G.S., Lightowlers, R.N., Turnbull, D.M. Mitochondrial Diseases: Hope for the Future. Cell. 2020 Apr;181(1):168-188. Retrieved from https://doi.org/10.1016/j.cell.2020.02.051
2. Mok, B.Y. et al. (2020). A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing. Nature. 2020 Jul;583:631-637. Retrieved from https://doi.org/10.1038/s41586-020-2477-4
3. Aushev, M., Herbert, M. Mitochondrial genome editing gets precise. Nature. 2020 Jul;583(7817):521-522. Retrieved from http://doi.org/10.1038/d41586-020-01974-6





 留言列表
留言列表 {{ article.title }}
{{ article.title }}
